감사합니다。
먼저 우리 두 쌍의 결과값을 보면 whey 첨가율에 따라 생존율의 일정한 변화는 보이지 않습니다. 0.1보다 아무것도 첨가하지 않은 NT의 생존율이 다소 높지만 1이나 10 정도의 첨가율이 NT값보다 높기 때문입니다. 따라서 해석을 하면 소량의 0.1을 첨가하는 것보다는 전혀 넣지 않거나 1에서 10 정도의 양을 첨가해야 세포에 더 좋다는 것을 알 수 있습니다.(+이러한 해석은 고찰에 적어주세요)!)! 그리고 다른 실험적 요인으로 인해 마치 세포 목성이 존재하는 것처럼 보이기 때문에 이러한 해석은 좋지 않습니다.라는 코멘트를 받는다.)
결과를 도출하는 데 비교할 대상이 많지 않았고, 1조와 2조의 값을 모두 가지고 그래프를 만들어 본 결과 2조 단독 결과와는 약간 다른 모습을 보였습니다. 위는 1조와 2조의 결과를 모두 합친 값입니다. 이 결과를 보면 NT값과 나머지 값 사이에 일정한 변화나 큰 차이가 없기 때문에 실험이 잘못되었거나 whey의 청가 또는 첨가율이 큰 의미를 갖지 않는다고 해석할 수 있습니다.4.2cell counting
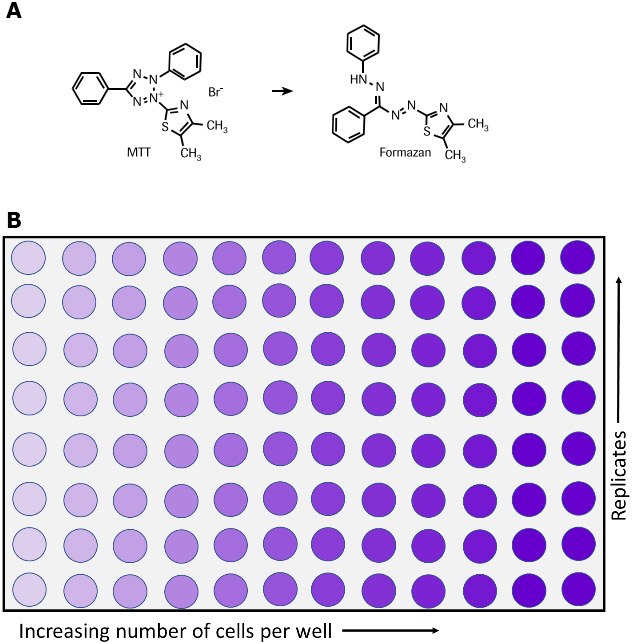
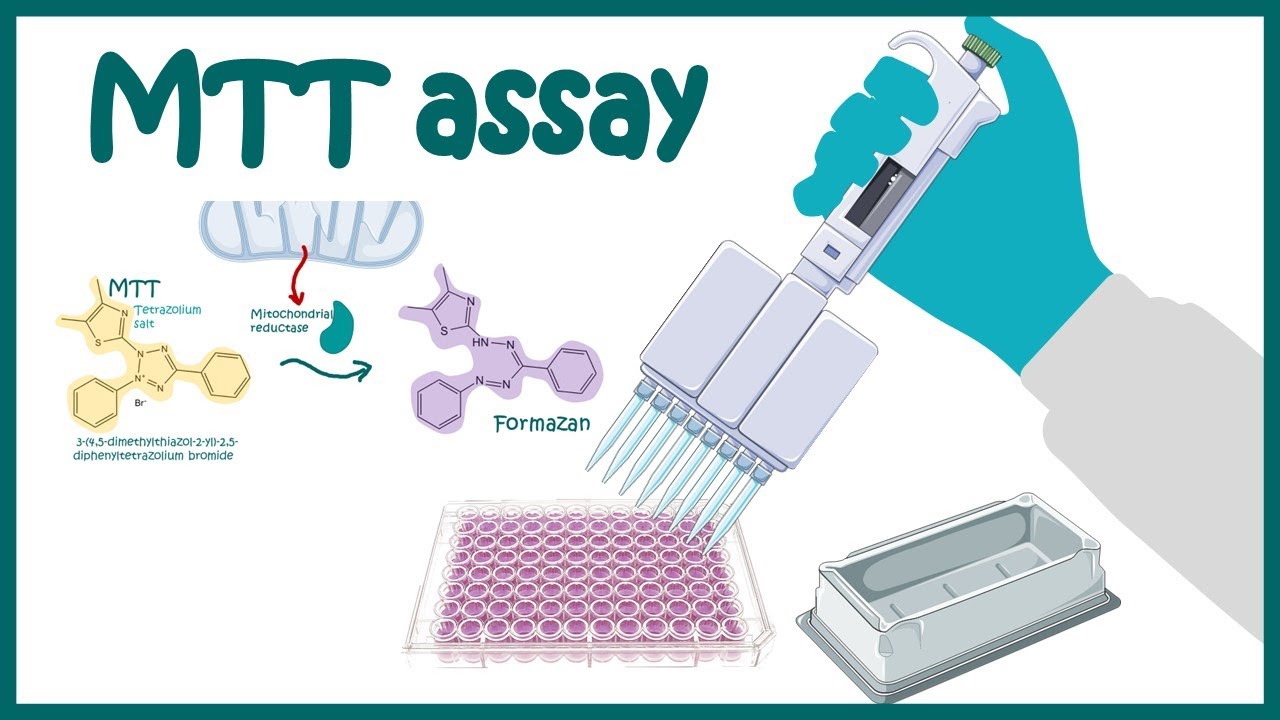
회원끼리 한 부분씩 맡아 세어 합친 숫자가 144이었습니다. 그 후(144/4)*2*10^4을 한 뒤 과학적 표기법으로 바꾸어 7.2*10^5가 나왔습니다. 5. Discussion 5.1 MTTassay.-세포의 사멸 정도로 육안으로도 미세한 빛깔의 차이를 구분할 수 있고, 또 작은 plate속에서 여러가지 well을 사용하고 다양한 조건에서 실험을 하고 바로 옆에서 비교한다는 정이 매우 효율적인 방법이라고 생각했다.-MTT는 빛에 약한 시약이라 항상 은박지에 싸서 사용하여 전기를 끄는 등 최대한 빛에 맞지 않도록 하면서 실험을 실시했습니다 그러나 가장 강력하고 직접적인 빛인 현미경으로 관찰할 때 직접 해당하는 불에 의해서 영향을 받지 않을까 생각하게 되었습니다. 그러나 이는 관찰 때문에 어쩔 수가 없는 부분이기 때문에 최대한 밝기를 조정하고 관찰한 것이 좋으며 시간적 여유가 있으면 2~4시간 방치이어서 2시간 후에 확인하고 또 1시간 후에 확인하는 것보다 처음부터 4시간 가까이 확인하고 현미경 빛에 노출되는 시간을 줄이는 것도 좋은 방법이라고 생각했다.-MTTassay할 때 96-well에 세포를 seeding하기 전에 cell counting을 통해서 적절한 양의 세포 수가 있는지 확인하고, 많으면 희석하고 적은 경우에는 그대로 사용하는 방식으로 세포 수를 일정하게 조절하고 실험을 시작하지 않으면 실험 결과에 오류가 발생하지 않습니다-실험에 사용한 RAW 264.7 cell은 부착형 세포이기 때문에 well의 바닥에 달라붙어 자랍니다. 실험 초반에 cell을 키운 뒤 왜 고급 즙을 취하고 버릴 때 세포가 따라오지 않고 위에 있는 배지 또는 whey만을 제거할 수 있습니다. -96-well plate에서 실험을 하는 것은 처음이었지만, 매스가 생각보다 좁고 각 well사이의 간격이 좁아 고급 액을 제거하는 데 전체 plate를 기울이고 잡아 바닥에 달라붙지 않도록 담벼락에 대거나 중간 파이 펫의 첨단을 넣어 빨아들이기에도 아직 익숙하지 않아 밑에 있는 세포를 긁거나 손상시켰습니다. 파이 펫의 길이가 긴 것도 아닌데 정확하게 미세하게 수면이 위축되면서 함께 조금씩 내려가며 마셔야 할 것이지만, 파이 펫에 익숙하지 않고 well의 바닥을 만지며 세포가 계속 붙어 있어야 하는데, 가끔 판 부분이 고급 액을 모두 제거하고 DMSO을 넣기 전에 확인하고 보니 육안으로도 확인되었습니다. 우리 반 실험에 오차가 있으면 그 부분이 가장 크게 작용했을 것입니다. 게다가 남김없이 벗긴 것은 아니고 각 농도 다른 사람이 한 때문에 벗겨지다 정도가 달라서 실험 결과가 더 정확하지 않을 것 같아요. 점점 숙련도를 높여서(숨을 참거나)시간이 걸리더라도 지금보다 더 천천히 하면서 정확도를 높여야 한다고 생각합니다. 또 안전하게 더 잘 빨아들이기 때문에 plate을 기울였는데 자꾸 위의 well에 있는 용액이 아래로 흐르는 것 아닐까 무서워서 각도를 크게 기울일 수 없었습니다. 다음부터는 안전한 범위 내에서 더 기울이고 실험을 합니다. -결정이 생긴 것을 현미경으로 확인한 결과 세포가 포도 송이처럼 굳은 것과 비슷한 크기로 세포의 포도 송이의 근처에 꽤 많은 양이 결정하고 있음을 발견했습니다. 그러므로 DMSO에서 확실히 녹이지 않으면 결과에 잘못을 저지를 수 있으므로 정확하게 녹이는 것이 중요하다고 생각했습니다. -실험에 대해서 좀 더 알아보았지만 formazandye의 최대 흡수도는 540nm부근으로 밝혀졌습니다. 또 세포 생리적 상태나 세포의 종류에 따라서미토콘드리아 탈수소 효소 활성의 차이가 나타나는 것이 밝혀졌습니다. 그리고 처음에 고급 즙을 취할 때에 부착형 세포이므로 비교적 간소했다고 느꼈는데요, 그래서 이 방법은 suspension cell에 적용하기 어려운 단정도 밝혀졌습니다. 그러나 비교적 간편하고 정확하게 세포 성장 및 사멸도의 변화를 평가할 수만 아니라 multi-wellplate를 사용하고 대량의 시료를 동시에 측정할 수 있어 invitro상의 세포 활성을 평가하는 데 널리 쓰이고 있다고 합니다. 5.2 cell counting- 다른 조와 같은 well예 있는 세포를 이용하고 이론적으로는 모두 같은 값이 나와야 하는데 각조마다 세포의 개수가 다른 이유는 모두 실험에서 발생한 오차가 붙어 발생한 것 같아요. -먼저 사용한 세포는 HT-29로 부유형 세포가 아니라 부착형 세포입니다. 그래서 같은 장소에서 찍어 희석시켰다고 해도 세포가 용액 전체에 균일하지 않았을 확률이 높아요. 또 타고 과정. 또 파이 페팅의 과정에서 세포가 손상됐을 가능성이 있습니다.-2번째는 hemocytometer사용 과정에서 일어났을 가능성이 있습니다. 수직으로 떨어뜨린다고 생각했는데 사실은 측면에서 파이 펫을 들게 고정시키고 한번에 축으로 내뱉는 방법으로 hemocytometer속에 세포를 떨어뜨리는 방법이었습니다. 이 과정에서 기포가 생겨서는 안 되는데 우리 조의 경우는 너무 강하게 누르는 바람에 기포가 생겼습니다. 이런 부분에서 오차가 발생했다고 생각합니다. 마지막으로 카운팅입니다. 카운트할 때 지금 보고 있는 셀 이 강했을지 무척 헷갈리고 있었습니다. 한 사람이 한개의 구역을 헤아리기에도 오차가 생길 위험성이 그만큼 큰 실험에 참가한 모두가 각기 다른 구역을 카운트하면서 적어도 더 카운트했다고 생각합니다. 이것은 나의 경우 눈금을 보고 가로 방향으로 한줄씩 빠른 스피드를 올리는 방식으로 해결했습니다. 하면 현기증이 나는데도 2번이나 확인한 것에 차이가 없었기 때문입니다. 6. References-김·주현 홍·김정일. (2018). 빛, 용매와 zinc protoporphyrin에 의한 MTT포마장의 화학적 동태 변화. 한국 식품 과학 학회지, 50(1). 1-7.-박 교은아, 최 현아, 돈 밀리, 최 유미, 김현정, 홍 쇼우이찌.(2011). MTT formazan의 발색에 미치는 zinc protoporphyrin의 영향. 한국 식품 과학 학회지, 43(6). 754-759.

감사합니다。



